

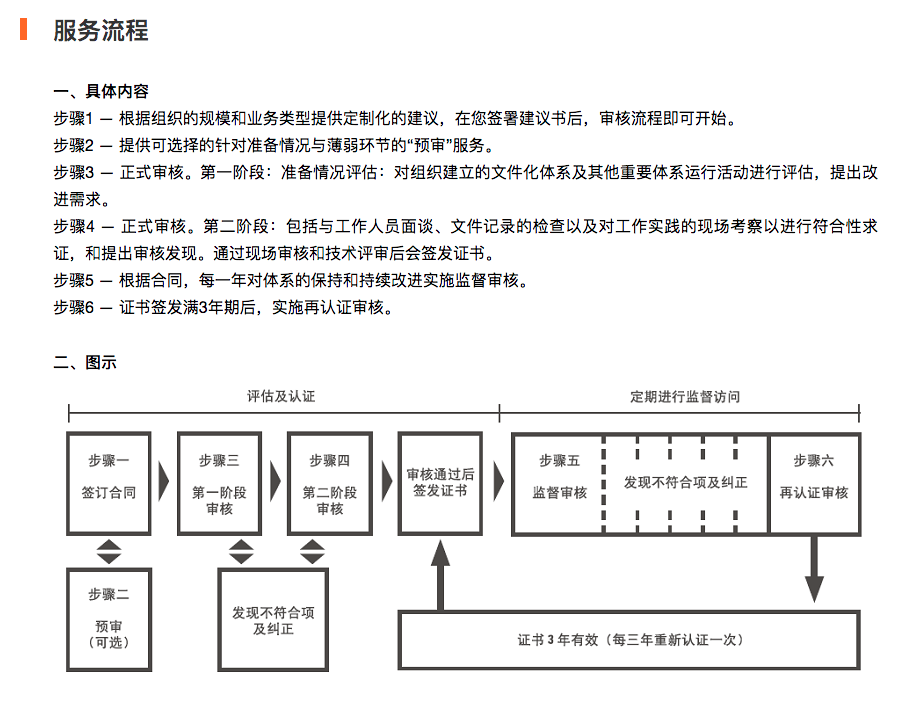
GDP 认证简介
欧必美 GDP 认证业务由欧必美集团联手 SGS 集团为您推出。SGS 是医药认证领域全球认可的领军机构。
SGS 颁发的 GDP 有效证明可以表明您的组织注重每项服务的质量,是医疗保健供应链中可靠的合作伙伴。
GDP认证使药品在供应链中保持质量,它将帮助你在管理药品的仓储及配送的环节,注重药品的追溯性及安全性需求,避免混淆,污染,交叉污染,假货及人为错误。同时,GDP也是药厂对其药品配送公司的基本要求,使你从竞争中脱颖而出。
认证益处
一、协助企业识别GDP规范,在监管部门或资助方实施检查前发现不足。
二、确保药品制造(Rebelling&Repacking)、贮存、配送和处理等遵照WHO GDP规范要求。
三、证明参与经营、流通的所有相关方(如供应商和贸易商)符合WHO GDP规范要求。
四、提高和改善企业的管理水平,增加企业的知名度。
五、确保药品在流通过程中的质量与出厂的一致性,使企业获取更大的经济效益。
六、有利于消除贸易壁垒,取得进入国际市场的通行证。
七、有利于增强产品竞争力,提高产品的市场占有率。


解决方案
针对组织不同层次的职员,我们可为您提供各种药品GDP培训课程,帮助组织提升职员的能力及意识:
一、管理体系类
1. GMP/GDP标准的概述
2. WHO GDP课程进修
3. 药品GDP法规要求解读
4. 药品GDP内审员培训
5. 药品GDP主任审核员培训
二、专题技术类
1. 库房虫害控制
2. 清洁和消毒知识讲解
3. 洁净厂房运行与维护技能提升
三、客户定制类
1. 定制化的药品GDP管理体系建立和运行辅导
2. 企业现场差距分析(包括预审核和评估)
3. 定制化的管理技能培训
4. 其他应客户要求的定制化解决方案
关于「WHO GDP认证」的更多信息
合规常见问题
一般也包括中成药、中药材、保健品及医疗器材。
您需要提供审核人员的所有差旅费用。
根据您填写的仓库数目、现场数等基本信息,客服人员会尽快为您提供报价。
根据审核员老师的排期情况,一般2个月左右可安排审核。
在您关闭所有不符合项后,4到6周即可获证。
国家食品药品监督管理局对于风险等级的认定情况如下:
第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。故一类产品医疗器械实行产品备案管理。
第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。
第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。故第二类、第三类医疗器械实行产品注册管理。
第一类医疗器械产品备案和申请第二类、第三类医疗器械产品注册,应当提交下列资料:
1.产品风险分析资料;
2.产品技术要求;
3.产品检验报告;
4.临床评价资料;
5.产品说明书及标签样稿;
6.与产品研制、生产有关的质量管理体系文件;
7.证明产品安全、有效所需的其他资料。
医疗器械注册申请人、备案人应当对所提交资料的真实性负责。
除了西药,GDP也可以包括其他产品吗?
一般也包括中成药、中药材、保健品及医疗器材。
我们的合规专家库
-
王博维 - 医疗器械合规领域权威专家,擅长所有业务
感谢您联系奥斯曼!
我们的团队已收到您的消息,并将尽快回复您。
400-88-45670
请您拨打上面的电话号码

