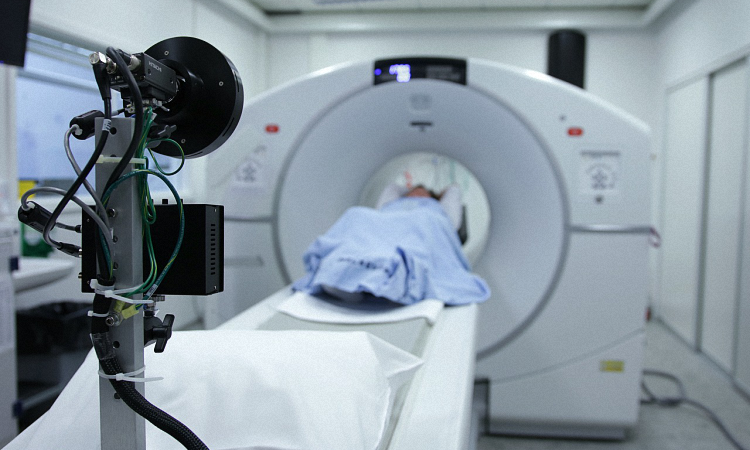
医疗器械临床试验
医疗器械临床试验是指:获得医疗器械临床试验资格的医疗机构(以下称医疗机构)对申请注册的医疗器械在正常使用条件下的安全性和有效性按照规定进行试用或验证的过程。医疗器械临床试验的目的是评价受试产品是否具有预期的安全性和有效性
临床试验的分类
医疗器械的临床试验分为医疗器械临床试用和医疗器械临床验证。对市场上尚未出现过,安全性、有效性有待确认的医疗器械,在批准上市前需要进行医疗器械临床试用研究。对同类产品已上市,其安全性、有效性需要进一步确认的医疗器械,在批准上市前需要进行医疗器械临床验证研究。
关于「临床及动物试验」的更多信息
合规常见问题
一般也包括中成药、中药材、保健品及医疗器材。
您需要提供审核人员的所有差旅费用。
根据您填写的仓库数目、现场数等基本信息,客服人员会尽快为您提供报价。
根据审核员老师的排期情况,一般2个月左右可安排审核。
在您关闭所有不符合项后,4到6周即可获证。
国家食品药品监督管理局对于风险等级的认定情况如下:
第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。故一类产品医疗器械实行产品备案管理。
第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。
第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。故第二类、第三类医疗器械实行产品注册管理。
第一类医疗器械产品备案和申请第二类、第三类医疗器械产品注册,应当提交下列资料:
1.产品风险分析资料;
2.产品技术要求;
3.产品检验报告;
4.临床评价资料;
5.产品说明书及标签样稿;
6.与产品研制、生产有关的质量管理体系文件;
7.证明产品安全、有效所需的其他资料。
医疗器械注册申请人、备案人应当对所提交资料的真实性负责。
除了西药,GDP也可以包括其他产品吗?
一般也包括中成药、中药材、保健品及医疗器材。
我们的合规专家库
-
王博维 - 医疗器械合规领域权威专家,擅长所有业务
感谢您联系奥斯曼!
我们的团队已收到您的消息,并将尽快回复您。
400-88-45670
请您拨打上面的电话号码

