
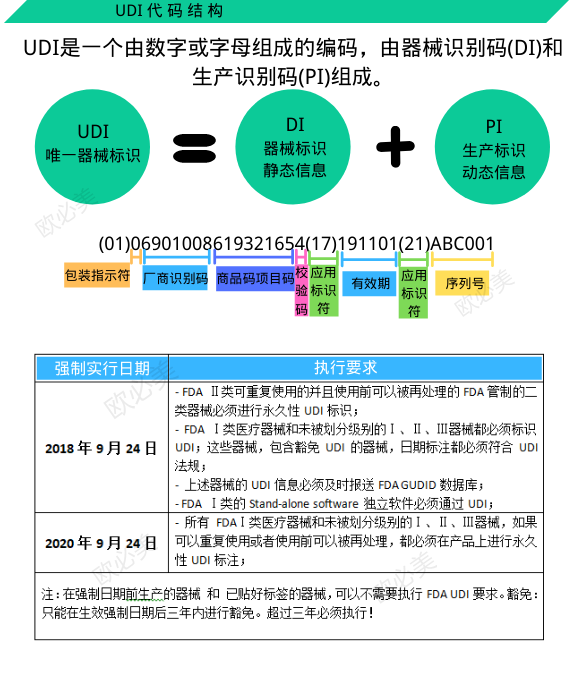
UDI
唯一器械标识(Unique Device Identification,缩写UDI),是一种在医疗器械产品或者包装上附载的,由数字、字母或者符号组成的代码,用以对医疗器械进行唯一性识别。
完整的UDI系统包括唯一标识、数据载体和数据库三部分。唯一标识是医疗器械产品的电子身份证;数据载体是存储或者传输医疗器械唯一标识的数据媒介;数据库是储存医疗器械唯一标识的产品标识与关联信息的数据库。
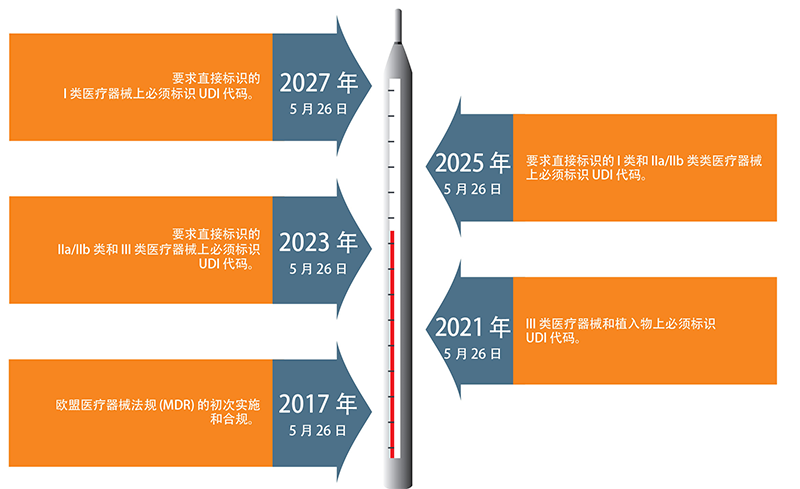
在信息时代背景下,UDI是实现医疗器械产品自动化识别、精准召回、追踪追溯、全过程通查通识、信息互联互通、智能化管理的关键基本要素。
UDI由哪些内容组成?
UDI由器械标识(Device Identification,DI)和(或)生产标识(Production Identification,PI)组成。
DI是UDI的必须、固定部分,由企业识别码和产品规格码两部分组成。企业识别码由注册人或备案人申请,由符合我国医疗器械编码规则和编码标准的发码机构依申请受理,并分配全球唯一的企业识别码;产品规格码是注册人或备案人根据其生产的产品型号、规格及包装等特征编制的代码。由企业标识码和产品规格码组成的DI是全球唯一的。
PI是医疗器械唯一标识的非必须、可变部分,包括生产日期、失效日期、批号或序列号等。PI的数据不需要上传编码数据库,所有单位可采用通用扫描设备在本地解析相关生产信息。
UDI应当符合唯一性、稳定性和可扩展性原则。唯一性是UDI的首要原则,确保产品的唯一标识不重复是精确识别的基础,也是唯一标识发挥功能的核心原则;稳定性原则要求UDI应当与产品基本特征相关,若产品的基本特征未变化,产品标识应当保持不变;可扩展性原则要求UDI应当适应监管要求和实际应用的不断发展。
UDI申请流程
第一步:申请和设计UDI
1、向签发机构申请产品编码(DI)
2、编制UDI (由DI+PI组成,DI向签发机构申请,PI厂商按照编码规则自行编制)
3、UDI 运行(将UDI加印在医疗器械上)
第二步:申报和维护UDI
4、收集GUDID 需要的信息(获取邓白氏码、获取GMDN code)
5、申请GUDID账号
6、数据提交GUDID
我们的服务:
UDI项目辅导
1、帮助企业进行项目规划
2、向签发机构申请DI
3、帮助企业编制UDI,并写入程序文件
4、帮助企业建立贴标的标准操作流程
5、收集相关数据,为UGDID申请做准备
UGDID申报
1、作为企业的UDI法规事务联络人
2、UGDID账号申请
3、UGDID数据提交
4、UGDID数据更新与维护
关于「UDI」的更多信息
合规常见问题
FDA 认证主要分为「FDA 注册」和「510K 认证」这两块。豁免产品只需要做 FDA 注册即可,非豁免产品除了做 FDA 注册还需要做 510K 认证。判断您的产品是否豁免,可以免费向我们咨询。
【FDA 注册】费用主要包括「FDA 官费」和「注册服务费」。官费每年 FDA 收的都不一样(会逐年上涨),2021 年是 5000 多美金。服务费是咨询机构收取的,各不相同。
【510K 认证】费用主要是技术文档撰写服务费,也是咨询机构自定,一般在 5 万元左右。
顺利的话 1 周左右即可完成 FDA 注册。
在您完成 FDA 注册获得 Owner/Operator Number(业主/经营者编号)及 Listing Number (上市编号)之后就可以开始出口了。并不需要等到 FDA 官网可以查询之后,甚至获得您的 Registration Number (注册码)之后。
在您的产品抵达美国海关时,只需出具 Owner/Operator Number 及 Listing Number 即可进行清关。
完成 FDA 注册之后,一般需要等待 1 周左右才能在 FDA 官网查到。
此外如果生产企业发生违规行为或在美销售的产品被发现有问题,FDA 注册号可能会被注销掉。因此生产企业一定要和美代之间保持良好关系和紧密联系,及时应对和处置相关事宜。美代(美国代理人)是您和 FDA 之间唯一的桥梁。
特别提醒一下:极少数企业容易忽视诚信,故意拖欠美代的服务费等。美代是可以直接向 FDA 申请注销这些企业的产品注册号的!切不可忽视!
产品生产企业对 FDA 注册/认证的重视程度,直接决定了产品是否能以最快的速度登陆美国市场进行销售。
FDA 对进口产品有一项管理措施叫「自动扣留」,即对于存在潜在问题的进口产品,入关时必须进行逐批检验(而不是抽查)。这些产品经美国相关实验室检验合格后,方才放行允许进入美国市场销售。
由于 FDA 工作人员少,面对进口产品规格多、数量大的局面,几乎不可能做到逐批检验,因此一般采取的是「抽查制」。抽查取样比率一般在 3~5%,合格则该批产品放行通关;不合格则触发「扣留机制」,产品上市进度将会大大受阻。
是的,必需。
FDA 规定,美国之外的产品在进入美国之前必须进行注册,同时必须指定一位美国代理人(就像我们欧必美这样的机构)。美国代理人作为 FDA 和国外产品企业之间的纽带,负责紧急情况和日常事务传达交流。
不会。完成注册后只会得到一个注册号,凭此注册号即可顺利在美国海关完成产品清关。
前面我们说过(↙看左下方),国内业界的「FDA 认证」说法只不过是一些人为了方便产品方理解提出的,在美国实际就是注册。如果是认证,为了隆重其事,往往给制作一个证书;但注册就真的只是信息登记,登记完了给一个凭证(也就是注册号)就可以了。再说了,美国海关也不认什么证书,人家只认这个注册号!而您的产品只要顺利完成清关,即可在美国上市销售啦~
不存在的...
FDA 是一个执法机构而不是服务机构,因此并没有面向公众的服务性机构与实验室,也没有所谓的「指定实验室」。
FDA 作为美国联邦执法机构,只会对服务性的检测实验室出具的 GMP 质量报告进行认可,并对于合格的颁发合格证书。所以并不会「指定」或「推荐」认证机构。这就跟「裁判并不能同时当球员」是一个道理:既不能又吹哨又踢球,更不能指定进球——否则那就是黑哨了。
没错,FDA 注册就是 FDA 认证。
因为在美国和在中国,食药监采取的是不同的管理措施。在中国,要求所有产品必须先通过检测机构或监管机构的审核认证;而美国则相对比较宽松,采取的是注册制。相比较而言,注册制比认证制对于产品的行政准入门槛要低一些,有利于产品更快的投向市场。当然了,这绝不等于说安全要求就低了。所以任何想出口产品到美国的企业,都不可大意侥幸。
FDA 是食品药品监督管理局(Food and Drug Administration)的简称,是美国政府在其健康与人类服务部 (DHHS) 下属的公共卫生部(PHS) 中设立的执行机构之一。
FDA 的职责是确保在美国销售的食品、化妆品、药物、生物制剂、医疗设备和放射产品等是安全的。
FDA 注册就是进行 FDA 规定的一个产品登记。
FDA 认证需要多少钱??
FDA 认证主要分为「FDA 注册」和「510K 认证」这两块。豁免产品只需要做 FDA 注册即可,非豁免产品除了做 FDA 注册还需要做 510K 认证。判断您的产品是否豁免,可以免费向我们咨询。
【FDA 注册】费用主要包括「FDA 官费」和「注册服务费」。官费每年 FDA 收的都不一样(会逐年上涨),2021 年是 5000 多美金。服务费是咨询机构收取的,各不相同。
【510K 认证】费用主要是技术文档撰写服务费,也是咨询机构自定,一般在 5 万元左右。
我们的合规专家库
-
王博维 - 医疗器械合规领域权威专家,擅长所有业务
感谢您联系奥斯曼!
我们的团队已收到您的消息,并将尽快回复您。
400-88-45670
请您拨打上面的电话号码

